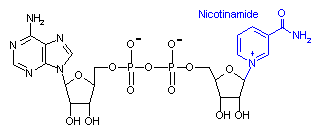
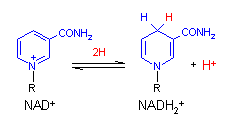
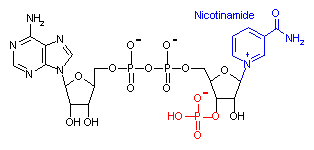
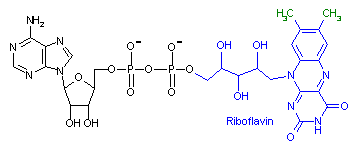
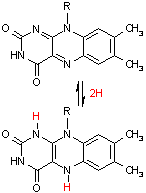
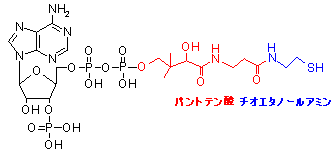
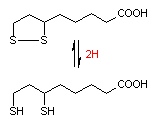
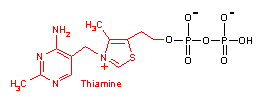
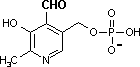
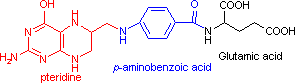
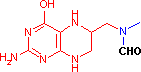
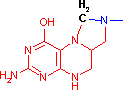
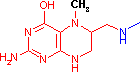
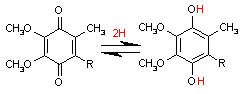
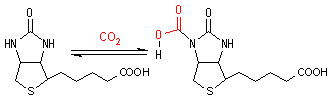
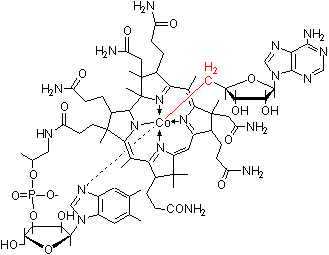
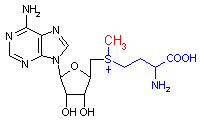
補酵素の働きの例として,乳酸デヒドロゲナーゼによる触媒反応に補酵素(NADH2+)がどのように関与するかを示す。
 |
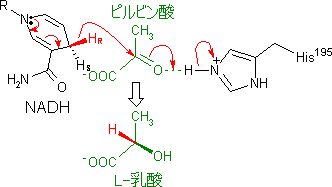 乳酸デヒドロゲナーゼのNADHから,Hがピルビン酸に移動する。同時に,酵素の活性中心のHis-195のイミダゾール基のHがピルビン酸のカルボニル基のOによって引き抜かれてOHとなり,乳酸が生じる。この反応は立体選択的で,生じる乳酸はL型である。 |
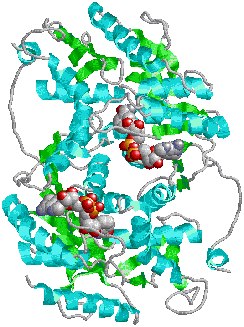
| ブタ筋肉乳酸デヒドロゲナーゼ(二量体) 中央に2分子のNADHが結合 |
乳酸デヒドロゲナーゼの触媒機構 |
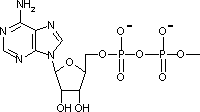



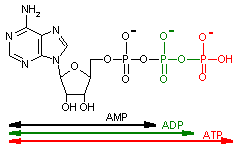
 アデノシン三リン酸 (Adenosine triphosphate, ATP)
アデノシン三リン酸 (Adenosine triphosphate, ATP)