



解糖−反応 |
 |
 グルコースのリン酸化(転移反応)
グルコースのリン酸化(転移反応)
 |
不可逆 ヘキソキナーゼ |
 |
 |
||
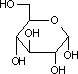
| D-グルコース | ATP ADP Mg2+ |
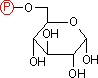
グルコース 6-リン酸 |
 酵素の性状: ヘキソキナーゼ [EC 2.7.1.1] またはグルコキナーゼ [EC 2.7.1.2]
酵素の性状: ヘキソキナーゼ [EC 2.7.1.1] またはグルコキナーゼ [EC 2.7.1.2]
 |
灰色:炭素 青:窒素 赤:酸素 橙色:リン 緑:Mg2+ |
 |
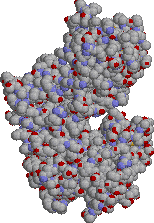 |
||
| 酵母ヘキソキナーゼの構造 | ヒト脳ヘキソキナーゼの構造 | |
| 分子中央に基質を結合する深い溝が見える。結合するグルコースは分子の中に完全に埋もれてしまう。 | 酵母の酵素が2つ結合したような構造をもつ2価の酵素で,これがさらに二量体をつくる。基質であるグルコースは酵素分子の奥深くに埋もれている。 | |
| [一言] 脳の一部,腎臓髄質,赤血球はグルコースを唯一のエネルギー源とする臓器または細胞である。脳は,緊急時にはケトン体を使う。脳は体重の2%を占めるに過ぎないが,グルコース消費量は全体の20%にも達する。 |
解糖−反応 |
  |
 グルコース 6-リン酸の異性化(異性化反応)
グルコース 6-リン酸の異性化(異性化反応)
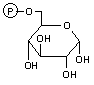 |
グルコースリン酸 イソメラーゼ  |
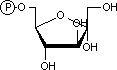 |
| a-D-グルコース 6-リン酸 | フルクトース 6-リン酸 | |
グルコース再生 |
グリコーゲン合成 |
|
ホスホグルコン酸経路 |
グルコース 6-リン酸 |  グルコース 1-リン酸 グルコース 1-リン酸 |
 フルクトース 6-リン酸 (解糖系) |
 グルクロン酸回路 |
 酵素の性状: グルコースリン酸イソメラーゼ [EC 5.3.1.9]
酵素の性状: グルコースリン酸イソメラーゼ [EC 5.3.1.9]
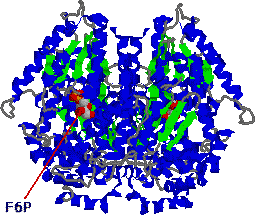 |
| グルコースリン酸イソメラーゼの構造 |
| 二量体タンパク質に,2分子のフルクトース 6-リン酸が結合している。 |
解糖−反応 |
  |
 フルクトース 6‐リン酸のリン酸化(転移反応): この反応は解糖の律速段階である。
フルクトース 6‐リン酸のリン酸化(転移反応): この反応は解糖の律速段階である。
 |
不可逆 ホスホフルクト キナーゼ-1  |
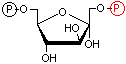 |
| フルクトース 6-リン酸 | ATP Mg2+ ADP | フルクトース 1,6-ビスリン酸 |
| ホスホフルクトキナーゼ活性 | ||
 |
ATP ADP Pi H2O |
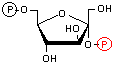 |
| フルクトース 6-リン酸 | フルクトース 2,6-ビスリン酸 | |
| フルクトース 2,6-ビスホスファターゼ活性 | ||
 酵素の性状: 6-ホスホフルクトキナーゼ [EC 2.7.1.11]
酵素の性状: 6-ホスホフルクトキナーゼ [EC 2.7.1.11]
 |
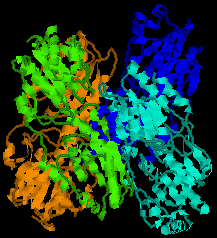 |
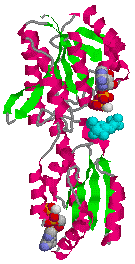
| 微生物ホスホフルクトキナーゼの構造 | ホスホフルクトキナーゼの4次構造 |
| a-へリックス(赤),b-シート(緑) 基質(F-6-P, 水色),Mg2+(白) 2分子のADPが基質の真上と分子下方に結合 |
4つのサブユニットを色分けしている。 |
解糖−反応 |
  |
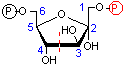
 フルクトース 1,6-ビスリン酸の切断(脱離反応)
フルクトース 1,6-ビスリン酸の切断(脱離反応)
 |
アルドラーゼ | 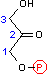 + +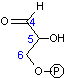 |
 |
||
| フルクトース 1,6-ビスリン酸 | DHAP + GAP |

 の場合は下の例と異なり,2種の異なる分子間でアルドール縮合が起こる(混合型アルドール縮合)。
の場合は下の例と異なり,2種の異なる分子間でアルドール縮合が起こる(混合型アルドール縮合)。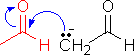 |
 |
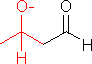 |
 |
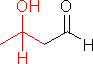 |
 酵素の性状: フルクトース 1,6-ビスリン酸アルドラーゼ(アルドラーゼ)[EC
4.1.2.13]
酵素の性状: フルクトース 1,6-ビスリン酸アルドラーゼ(アルドラーゼ)[EC
4.1.2.13]
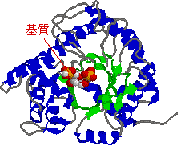 |
| アルドラーゼの構造 |
| 基質: DHAP + GAP |
解糖−反応 |
  |
 トリオースリン酸の異性化(異性化反応)
トリオースリン酸の異性化(異性化反応)
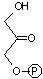 |
トリオース リン酸イソメラーゼ |
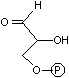 |
 |
||
| ジヒドロキシ アセトンリン酸 |
(DHAP) | グリセルアルデヒド 3-リン酸 (GAP) |
 酵素の性状: トリオースリン酸イソメラーゼ[EC 5.3.1.1]
酵素の性状: トリオースリン酸イソメラーゼ[EC 5.3.1.1]
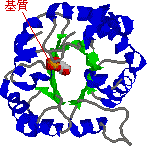 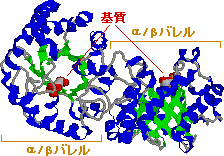 |
| トリオースリン酸イソメラーゼの構造 (左)酵母酵素の1つのサブユニット,(右)鶏の酵素 |
解糖−反応 |
  |
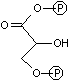
 グリセルアルデヒド 3-リン酸の酸化とリン酸化(酸化還元反応):
グリセルアルデヒド 3-リン酸の酸化とリン酸化(酸化還元反応): |
グリセルアルデヒド 3-リン酸 デヒドロゲナーゼ |
 |
 |
||
| グリセルアルデヒド 3-リン酸 |
NAD+ NADH2+ + Pi (無機リン酸) |
1,3-ビスホスホ グリセリン酸 [高エネルギー化合物] |
 酵素の性状: グリセルアルデヒド 3-リン酸デヒドロゲナーゼ[EC 1.2.1.12]
酵素の性状: グリセルアルデヒド 3-リン酸デヒドロゲナーゼ[EC 1.2.1.12]
 |
 |
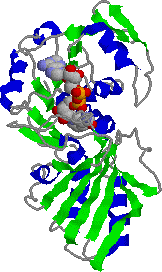
| グリセルアルデヒド 3-リン酸デヒドロゲナーゼの構造 | |
| 1つのサブユニット(左) NAD+が分子上方に結合 |
4次構造(右) 4つのサブユニット(色分けして示す) が,ほぼ正四面体状に配置している。 |
解糖−反応 |
  |
 1,3-ビスホスホグリセリン酸の脱リン酸化(転移反応): 最初のATP合成
1,3-ビスホスホグリセリン酸の脱リン酸化(転移反応): 最初のATP合成
 |
ホスホグリセリン酸 キナーゼ |
 |
 |
||
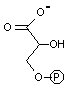
| 1,3-ビスホスホ グリセリン酸 |
ADP  |
3-ホスホグリセリン酸 |
|
 酵素の性状: ホスホグリセリン酸キナーゼ [EC 2.7.2.3]
酵素の性状: ホスホグリセリン酸キナーゼ [EC 2.7.2.3]
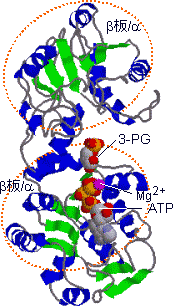 |
| ホスホグリセリン酸キナーゼの構造 |
解糖−反応 |
  |
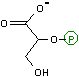
 3-ホスホグリセリン酸の異性化(異性化反応)
3-ホスホグリセリン酸の異性化(異性化反応)
 |
ホスホグリセロ ムターゼ |
 |
 |
||
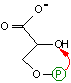
| 3-ホスホグリセリン酸 | 2-ホスホグリセリン酸 |
 酵素の性状: ホスホグリセロムターゼ [EC 5.4.2.1]
酵素の性状: ホスホグリセロムターゼ [EC 5.4.2.1]
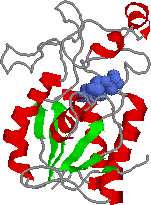 |
| ホスホグリセロムターゼの構造 |
| a-helix(赤),b-構造(緑),基質(青) |
解糖−反応 |
  |
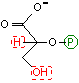
 2-ホスホグリセリン酸の脱水反応: 解糖系2つ目の高エネルギー化合物の生産
2-ホスホグリセリン酸の脱水反応: 解糖系2つ目の高エネルギー化合物の生産
 |
エノラーゼ | 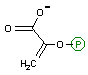 |
 |
||
| 2-ホスホグリセリン酸 | Mg2+ H2O | ホスホエノール ピルビン酸 [高エネルギー化合物] |
 酵素の性状: エノラーゼ [EC 4.2.1.11]
酵素の性状: エノラーゼ [EC 4.2.1.11]
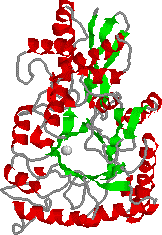 |
| エノラーゼの構造 中央の灰色球はMg2+イオンである |
解糖−反応 |
  |
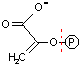
 ホスホエノールピルビン酸の脱リン酸化(転移反応): 第2のATP生産
ホスホエノールピルビン酸の脱リン酸化(転移反応): 第2のATP生産
 |
不可逆 ピルビン酸 キナーゼ  |
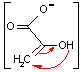 |
互変異性 |
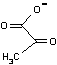 |
| ホスホエノール ピルビン酸 |
ADP  |
ピルビン酸 (エノール型) |
ピルビン酸 |
 酵素の性状: ピルビン酸キナーゼ [EC 2.7.1.40]
酵素の性状: ピルビン酸キナーゼ [EC 2.7.1.40]
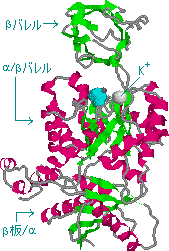 |
| ピルビン酸キナーゼの構造 a-helix(赤),b-構造(緑),ピルビン酸(水色) |
乳酸発酵−反応 |
  |
 ピルビン酸の還元: NAD+の再生
ピルビン酸の還元: NAD+の再生
 |
乳酸 デヒドロゲナーゼ |
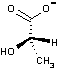 |
 NADH2+ NAD+ |
||
| ピルビン酸 | 乳酸 |
 酵素の性状: 乳酸デヒドロゲナーゼ(乳酸脱水素酵素)[EC 1.1.1.27]
酵素の性状: 乳酸デヒドロゲナーゼ(乳酸脱水素酵素)[EC 1.1.1.27]
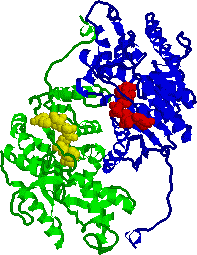 |
| 乳酸脱水素酵素2量体の構造 アポ酵素(緑と青),補酵素(NADH2+, 赤と黄) |
アルコール発酵−反応 |
 |
 ピルビン酸の脱炭酸と還元
ピルビン酸の脱炭酸と還元
 |
ピルビン酸デカ ルボキシラーゼ |
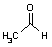 |
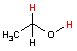
アルコール デヒドロゲナーゼ |
 |
 TPP CO2 |
 NADH2+ NAD+ |
|||
| ピルビン酸 | アセトアルデヒド | エタノール | ||
 酵素の性状: ピルビン酸デカルボキシラーゼ [EC 4.1.1.1]とアルコールデヒドロゲナーゼ(アルコール脱水素酵素)[EC
1.1.1.1]
酵素の性状: ピルビン酸デカルボキシラーゼ [EC 4.1.1.1]とアルコールデヒドロゲナーゼ(アルコール脱水素酵素)[EC
1.1.1.1]
 |
 |
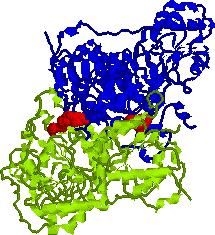
| ピルビン酸デカルボキシラーゼ 2量体の構造 アポ酵素(緑と青),補酵素(TPP, 赤) |
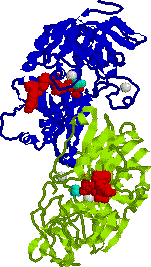
アルコール脱水素酵素2量体の構] アポ酵素(緑と青),補酵素(NADH2+, 赤), 4つの亜鉛イオン(灰色),エタノール(水色) |
| 補酵素(TPP)はサブユニットの界面に存在する。 | 基質であるエタノールが補酵素と接触し,水素添加を受ける。 |

|