
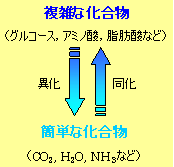
生体系は平衡状態ではないが、絶えず外界から物質を取り入れることによって、種々の活動を行うに必要なエネルギー(自由エネルギー)や生体系を維持するのに必要な化合物を得ている。外界からの取り込んだ物質を変化させる過程を代謝 (metabolism) と呼ぶ。代謝には異化と同化の2つがある。
- 外界から取り込んだ物質(食物)を分解し,より簡単な化合物に変えるとともにエネルギーを取り出す過程を異化 (catabolism) という。例えば,デンプンは我々の体内で消化されブドウ糖 (D-glucose) に変えられる。D-グルコースは解糖 (glycolysis) によってピルビン酸に変化するが、嫌気的条件ではさらに乳酸やアルコールへと変化する。もし酸素を利用できれば、D-グルコースは最終的に二酸化炭素と水にまで代謝され,大きなエネルギーを生み出すことができる。
- C6H12O6 + 6O2 → 6CO2 + 6H2O ⊿G0' = - 4928 kJ/mol
- 生体は化学変化で発生するエネルギーでATPやNADPH2+をつくる。エネルギー的に不利な反応を遂行するのにこれらの化合物を利用する。
生体内では,種々のカルボン酸,アミノ酸,二酸化炭素など限られた材料をもとに,生体が必要とするほとんどの物質がつくられる。これらの簡単な物質からより複雑な化合物をつくる過程を同化 (anabolism) と呼ぶ。例えば、植物や光合成細菌は二酸化炭素と水から光のエネルギーを利用して種々の糖質を合成する(光合成)。
- 糖新生はピルビン酸からD-グルコースをつくりだす過程である。一見するとこれは解糖の逆をたどる経路のように見える。しかしながら,解糖はいくつかの段階が不可逆であるため,単なる解糖の逆反応ではD-グルコースはつくれない。不可逆的な段階は別の様式の反応や別の経路が用意されている。このことは糖新生(同化)と解糖(異化)を独立に制御できることを意味する。このように異化と同化が別経路である例は,グリコーゲンの合成と分解や脂肪酸の合成と分解などに見ることができる。
- 化学反応における自由エネルギー変化(⊿G)は次の式で示される。
- ⊿G = ⊿G生成物 - ⊿G反応物 = ⊿Go + RT ln ([生成物]/[反応物])
- ⊿Goは標準状態(25℃,1気圧,濃度は1 M)での自由エネルギー変化で標準自由エネルギー変化という。
- 生体内の反応を議論する場合,水素イオン濃度 [H+}が1 M,つまり,pH=0では都合が悪いので、pH=7.0 ([H+}=10-7 M)を生化学的標準状態と定め,⊿Goの代わりに⊿Go’を用いる。
細胞内で最も重要な化学反応の1つはATPの加水分解反応である。
- ATP + H2O → ADP + Pi ⊿G0' = - 30.5 kJ/mol
- この- 30.5 kJ/molという値は標準状態の値で,実際の細胞内の⊿G'は約-50
kJ/molくらいになる。いま,細胞内のATP, ADP, Pi濃度がそれぞれ2.35 mM, 0.20
mM, 1.60 mMであるとすると,pH 7.0, 25℃での⊿G'は
- ⊿G' = ⊿Go''+ RT ln ([生成物]/[反応物]) = -30500 + (8.315 × 298}ln[(0.2 ×10-3)(1.6 × 10-3)/(2.35 × 10-3)]
= -30500 + 2.480ln(1.36 × 10-4) = -30500 +(-22100) = -52600 J/mol・K
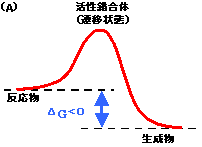
- となる。標準自由エネルギー変化から見て、この反応はエネルギー的に有利な反応といえる。このように⊿Goが負の反応を発エルゴン反応という。生体内では発エルゴン反応で放出される自由エネルギーを利用して、種々の仕事を行うことができる。
一方、D-グルコースのリン酸化反応は,次のように自由エネルギー変化が正である。
- D-glucose + Pi → D-glucose 6-phosphate ⊿G0' = + 13.8 kJ/mol
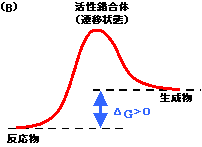
- 。このように⊿Goが正の反応を吸エルゴン反応という。このような反応はひとりでにはおき難く,外からの仕事が必要となる。生体内では,より大きな負の自由エネルギー変化を伴う発エルゴン反応とカップルさせることで吸エルゴン反応を進行させることができる(反応の共役という)。
- D-glucose + ATP → D-glucose 6-phosphate + ADP ⊿G0' = - 16.7 kJ/mol
|
  |
|
[(A)発エルゴン反応と(B)吸エルゴン反応] |
生体内でのエネルギー変換物質としては,上で述べたATPが最も重要である。ATPのように,加水分解反応で大きな⊿Goの減少を伴う化合物を,高エネルギー化合物と呼ぶ。F. Lipman & H. KalckarはATPを「全ての生物の高エネルギー通貨」と呼んだ (1941年)。ATPよりもADP+リン酸の方がよりエネルギー的に有利な理由を次に示す。
- 加水分解産物は共鳴で安定化するが,無水物型は安定化できない(図の赤)。
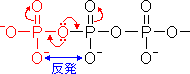 |
両方のリン原子が酸素原子の
非共有電子対を引き合うため、
共鳴安定化ができない。 |
- 無水物型では2つのO-部分が静電的に反発し,エネルギー的に不利である(上の図の青で示す)。これは加水分解により解消される。
- 水和エネルギーは,無水物型よりも加水分解産物のほうが大きい。
それでもATPが水の中で安定に存在できるのは、ATPの酸無水物結合の加水分解の活性化エネルギーが高いためである。ただし,酵素があれば簡単に加水分解される。生理的条件下(pH=7.0)では,ATP,ADP,Piの濃度はそれぞれ数mMであり,ATPの加水分解の⊿Gは約-50 kJ/molにも達する。注意して欲しいのは,ATPは「貯蔵エネルギー」ではなくて,「交換用のエネルギー」であることで,細胞内の濃度には上限がある。従って,細胞内ATP濃度が上昇するとATPはエネルギー生産の種々の段階の酵素を阻害して,その生産を抑制する。
このように,ATPはエネルギー物質として全ての生物に利用される。ATPは嫌気的生物では解糖で,好気的生物では解糖,光合成,酸化的リン酸化でつくられる。 高エネルギー化合物の中ではATPは中程度に位置する(下表)。もしATPが最上位の化合物であれば,ATP自体をつくるのが困難になるであろう。
高エネルギー化合物の例
| 化合物 |
⊿Go(kJ/mol) |
ホスホエノールピルビン酸
1,3-ビスホスホグリセリン酸
アセチルリン酸
ホスホクレアチン
ATP/AMP
ATP/ADP
グルコース 1-リン酸
フルクトース 6-リン酸
グルコース 6-リン酸
グリセロール 3-リン酸 |
-61.9
-49.4
-43.1
-43.1
-32.2
-30.5
-20.9
-13.8
-13.8
-9.2 |
- ある酸化還元反応の全反応は次のように表される。
- Aoxn+ + Bred→ Ared + Boxn+
- ここでAは電子受容体,Bは電子供与体である。その半反応は次のようになる。
- Aoxn+ + n e-→ Ared (半反応A)
Bred→ Boxn+ + n e- (半反応B)
- この反応の自由エネルギー変化(DG)は,
- DG = DGo + RT ln{[Ared][Boxn+]}/{[Aoxn+][Bred]}
DGo: 標準自由エネルギー変化
- また,ファラデー定数をFとすると,
- DG = -nFDE
- よって,DGo = -nFDEoとおくと,
- -nFDE= -nFDEo + RT ln{[Ared][Boxn+]}/{[Aoxn+][Bred]} (Nernstの式)
DEo: 標準還元電位
- DE>0ならばDG<0となり,反応は自発的に進行する。
半反応A,Bは次のようになる。
- EA = EAo + RT ln{[Ared]/[Aoxn+]}
EB = EBo + RT ln{[Bred]/[Boxn+]}
- よって,
- DE = EA - EB また,DEo = EAo - EBo
- となる。
生化学的標準状態では,[H+] = 10-7Mを採用し,DEやDEoの代りにDE'やDEo'を用いる。
標準還元電位(DEo)の値は,呼吸鎖や光合成の電子伝達系の反応のエネルギーの変化を考える際に必要である。
生化学的半反応の標準還元電位
*Bound to flavoprotein.
| 半反応 |
Eo' (V) |
1/2 O2 + 2H+ + 2e-→ H2O
シトクロムa3 (Fe3+) + e-→ シトクロムa3 (Fe2+)
シトクロムa (Fe3+) + e-→ シトクロムa (Fe2+)
シトクロムc (Fe3+) + e-→ シトクロムc (Fe2+)
シトクロムc1 (Fe3+) + e-→ シトクロムc1 (Fe2+)
シトクロムb (Fe3+) + e-→ シトクロムb (Fe2+)
ユビキノン+ 2H+ + 2e-→ ユビキノール
フマル酸+ 2H+ + 2e-→ コハク酸
FAD + 2H++ 2e-→ FADH2 (結合型*)
オキサロ酢酸 + 2H+ + 2e-→ リンゴ酸
ピルビン酸 + 2H+ + 2e-→ 乳酸
アセトアルデヒド + 2H+ + 2e-→ エタノール
FAD + 2H+ + 2e-→ FADH2 (free)
NAD+ + H+ + e-→ NADH
NADP+ + H+ + e-→ NADPH
H+ + e-→ 1/2H2(pH7) |
+0.815
+0.385
+0.29
+0.254
+0.22
+0.077
+0.045
+0.031
0
-0.166
-0.185
-0.197
-0.219
-0.315
-0.32
-0.421 |































