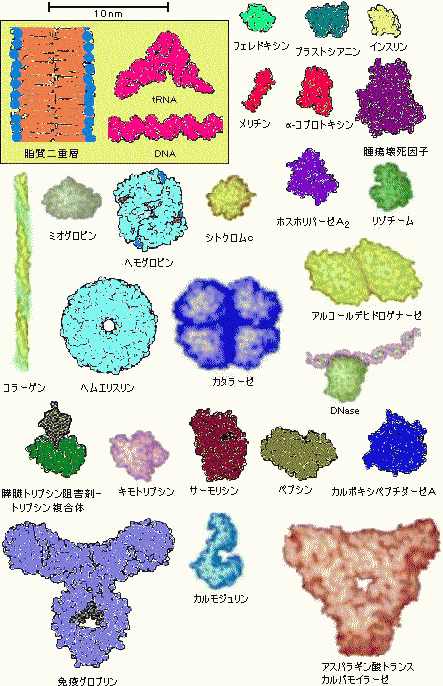


|
�A�~�m�_�@�y�v�`�h�@�^���p�N���@�^���p�N���̋@�\�ƕϐ��@�V�R�ϐ��^���p�N�� |

|
|
|
 |
  |
|
|
|
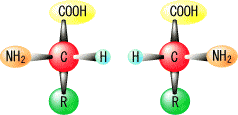 |
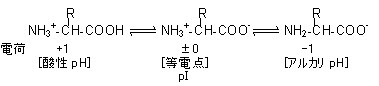 |
|
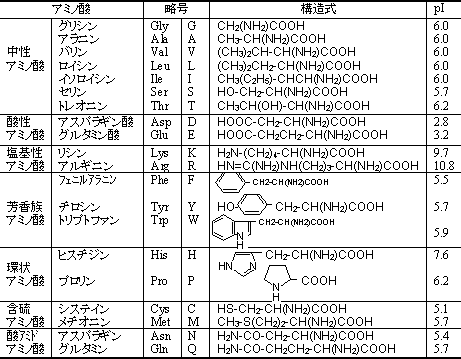
| �V�R�̃A�~�m�_��L�^ | D-�A�~�m�_ | �A�~�m�_�̓��d�_(isoelectric point, pI) |
| �A�~�m�_�̗��̉��w �O���V���ɂ͂k,D�̋�ʂ͂Ȃ��B | ||
 |
|
| �A�~�m�_ | �_�@ |
pKa |
| a-�J���{�L�V���� | 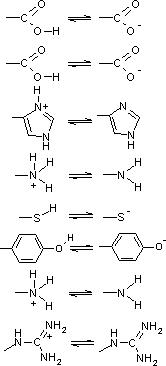 |
3.1 |
| Asp, Glu | 4.1 | |
| His | 6.0 | |
| a-�A�~�m�� | 8.0 | |
| Cys | 8.3 | |
| Tyr | 10.9 | |
| Lys | 10.8 | |
| Arg | 12.5 |
 �X�̃A�~�m�_�c��̓���
�X�̃A�~�m�_�c��̓���
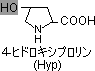
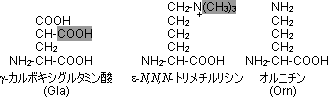
|
|
|
 |
  |
|
|
|
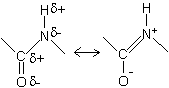
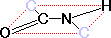
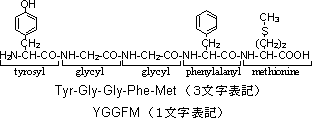
| ��� | �� |
| 1) �z�������y�v�`�h | �C���V�������C�I�L�V�g�V���C �A���W�I�e���V���U |
| 2) �R������ (D-�A�~�m�_�����A�~�m�_���܂ނ��̂�����) |
�y�j�V�����C�O���~�V�W��S |
| 3) �y�f�j�Q�y�v�`�h | ���C�y�v�`���C�y�v�X�^�`���C �A���g���v�V���C���q�r�^�[ |
| 4) �_�o�`�B���� | ���`�I�j���G���P�t�@�����C �T�u�X�^���X P |
| 5) �斡�y�v�`�h | �A�X�p���e�[�� |
| 6) �Ńy�v�`�h | AM-�g�L�V���C�A�}�j�`���C �R�u���g�L�V�� |
| 7) ���̑� | �O���^�`�I���i�זE���Ҍ��܁j |
|
|
|
 |
  |
|
|
|
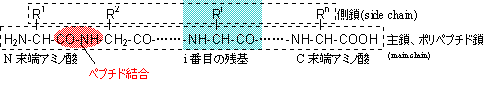
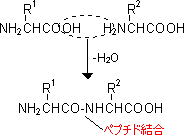
 1���\��(primary structure)
1���\��(primary structure)
|
| �^���p�N�� | ���d�_ |
| ������1-�O���u���� �n�v�g�O���u���� �����A���u�~�� ������1-Globulin �t�B�u���m�[�Q�� �w���O���r�� ������2-�O���u���� �y�v�V�� �����A���u�~�� �C���V������ �q�X�g�� ���{�k�N���A�[�[ �V�g�N���[��c ���]�`�[�� |
2.0 4.1 4.7 5.8 5.8 7.2 7.4 1.0 4.6 5.4 7.5-11.0 9.6 9.8 11.1 |
 �Q���\��(secondary structure)
�Q���\��(secondary structure) 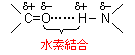
 �Ȃ��^���p�N����2���\�����Ƃ�̂��H
�Ȃ��^���p�N����2���\�����Ƃ�̂��H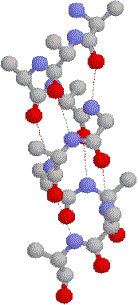 |
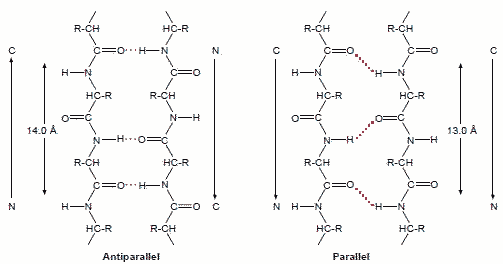 |
| a-helix | b-sheet |
 a-helix�̓���
a-helix�̓��� b-sheet�̓���
b-sheet�̓���
 �R���\��(tertiary structure)
�R���\��(tertiary structure) 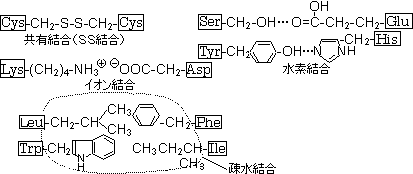
 |
 |
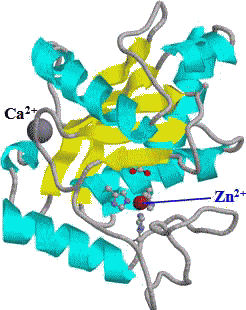
| �������]�`�[���̂R���\���B ���͎卽���������{���ŕ\�������̡�ԁCa-helix�C��Cb-sheet �E�͑S�Ă̌��q����ԏ[�U���f���ŕ\�������̡ |
|
 �S���\��(quarternary structure)
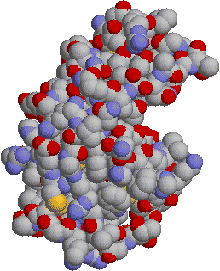
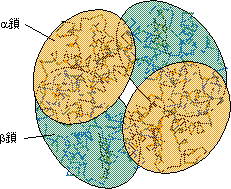
�S���\��(quarternary structure)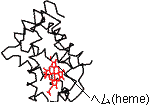 �w���O���r���̂P�� �T�u���j�b�g�̂R���\�� |
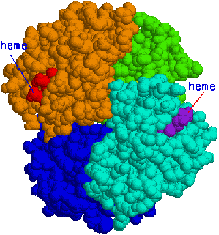
 �w���O���r���̂S���\�� |
 |
 �h���C��(domain)�̊T�O
�h���C��(domain)�̊T�O �������̃h���C���̗�F �������̃h���C���̗�F |
||
 |
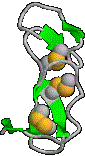 |
 |
| �Ɖu�O���u�����h���C�� 7�{��b-sheet���M��ɔz�u |
EGF�h���C�� 3��S-S������ �㉺�ɕ���ł��� |
a/b�o�����h���C�� |
| ��F�́C�V�X�`���c��̗������q | ||
 |
 |
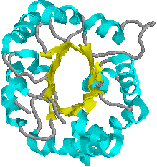
| �֓Ń��^���v���e�A�[�[�͕����̃h���C�����琬�� | ���^���v���e�A�[�[�h���C���̍\�� |
| ���ꂼ��̃h���C����F��ς��Ď���� �C���^���v���e�A�[�[�h���C���G�@�ԁC�f�B�X�C���e�O�����h���C���G �CCyrich�h���C���G ���CC�^���N�`���h���C�� |
 �^���p�N���̂P���\���̌���
�^���p�N���̂P���\���̌���| �\�����m�̃^���p�N�� ������ �����ȃ^���p�N�� ���Ҍ��܂�SS�������A���w�C������ ���������̃^���p�N�����y�f�ŕ������� �����̃y�v�`�h�f�� �������E�������� ���e�f�Ђ̃A�~�m�_�z������߂� ���e�f�Ђ̕��ѕ��𐄒肷�� �^���p�N���̑S�P���\�� |
 |
| �G�h�}������ |
|
|
|
 |
  |
|
|
|
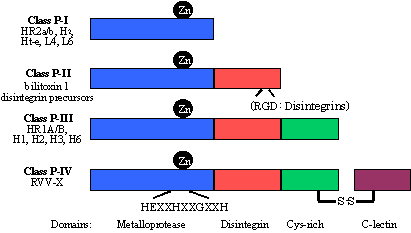
| ���� | �@�\ | �� |
| 1) �y�f 2) �y�f�j�Q�� 3) ���^���p�N�� 4) �z������ 5) �A���^���p�N�� 6) �h��^���p�N�� 7) �^���^���p�N�� 8) �Ń^���p�N�� 9) �����^���p�N�� 10)�\���^���p�N�� |
�G�}��p �y�f��p��j�Q �זE�����`�B �זE�ԏ��`�B �����A�� ���̖h�� �זE�̉^���� �זE�� �����h�{ �זE��זE�Ԃ̍\�z |
�g���v�V���A���_�E���f�y�f �}�N���O���u�����A�g���v�V���C���q�r�^�[ �z��������e�� �C���V�������A�����z������ �w���O���r���A���|�^���p�N�� �Ɩ��O���u�����A�t�B�u���m�[�Q�� �A�N�`���A�~�I�V�� �֓Ń^���p�N���A���V�� �O���V�j���A�J�[�C�� �R���[�Q���A���^���p�N���A�E�B���X�k�^���p�N�� |
| ��A�~�m�_���� | �� | |
| �j�^���p�N�� | �j�_ | �q�X�g���A�v���^�~�� |
| ���|�^���p�N�� | ���� | �������|�^���p�N�� |
| ���^���p�N�� | ���� | �O���R�z�����A�Ɩ��O���u���� |
| �F�f�^���p�N�� | �F�f�i�w���Ȃǁj | �V�g�N���[���A�w���O���r�� |
| �����^���p�N�� | �����C�I�� | �g�����X�t�F�����A�t�F���`���C���^���v���e�A�[�[ |
 |
�キ���M ��p |
 |
�������M |
 |
| ����(native)�^���p�N�� [����100%] |
�����ϐ���� [�ኈ��] |
���S�ϐ���� [�s����] |
||
| [�^���p�N���̕ϐ�] | ||||

|

|