細胞周期研究の流れ サイクリン-CDK複合体群とその阻害剤 細胞周期の制御
真核生物のDNA複製開始制御機構 チェックポイントの監視 pdfファイルの



|
細胞周期研究の流れ サイクリン-CDK複合体群とその阻害剤 細胞周期の制御 真核生物のDNA複製開始制御機構 チェックポイントの監視 pdfファイルの 
|
 |
|
|
|
|
 |
 |
|
|
|
|
|
|
 |
  |
|
|
|


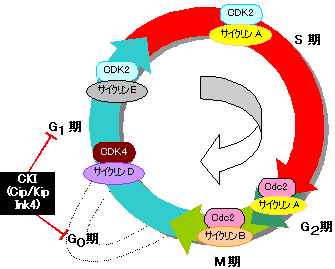 |
| G1期の通過: サイクリンD-CDK4 S期の開始: サイクリンE-CDK2 S期の通過: サイクリンA-CDK2 G2期の通過: サイクリンA-CDK1(Cdc2) M期の開始: サイクリンB-CDK1(Cdc2) また,種々のサイクリン-CDKの活性化に サイクリンH-CDK7複合体(CAKなど)が必要。 |
|
|
|
 |
  |
|
|
|
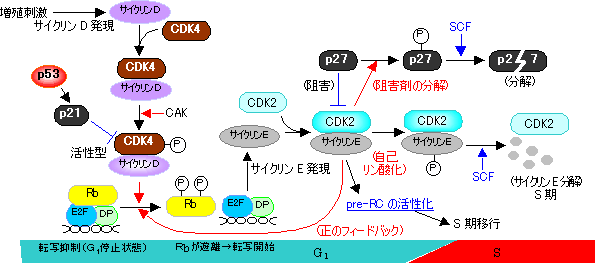
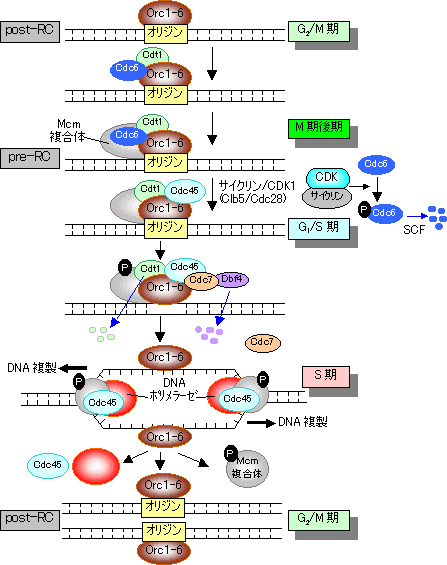
 G1からS期への移行の制御 (G1チェックポイントの分子機構)
G1からS期への移行の制御 (G1チェックポイントの分子機構)
 |
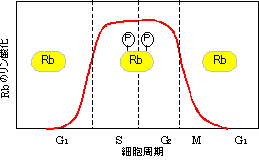
 M期への移行の制御(G2/Mチェックポイントの分子機構)
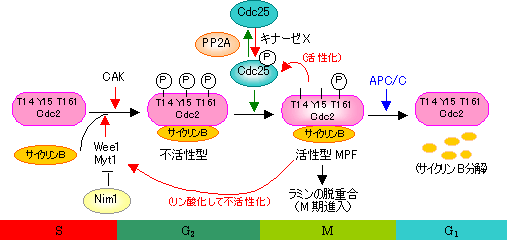
M期への移行の制御(G2/Mチェックポイントの分子機構)
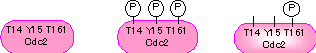 |
||
| 脱リン酸化型 (不活性) |
高リン酸化型 (不活性) |
低リン酸化型 (活性) |
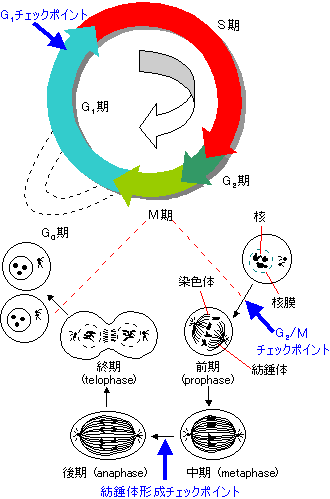
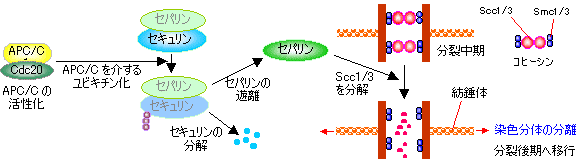
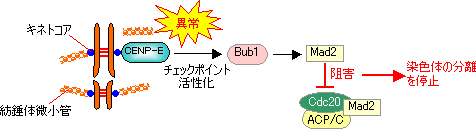
 紡錘体形成チェックポイント
紡錘体形成チェックポイント
|
|
|
 |
  |
|
|
|
|
|
|
 |
 |
|
|
|
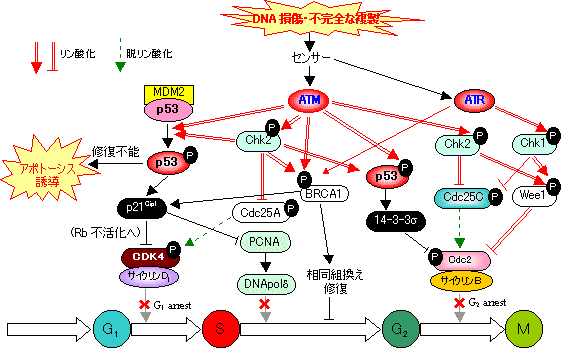
 p53 ---ゲノムの管理人(guardian of the genome)---
p53 ---ゲノムの管理人(guardian of the genome)---
 |
| p53分子のドメイン構成 |

|