 免疫小史
免疫小史

|
抗原と抗体 補体 免疫系の細胞と働き 抗体産生の理論 免疫化学的手法 |
免疫(immunity)とは 「疫すなわち病気を免れる」という意味である。感染性の疾病に一度かかると,同じ病気には抵抗性を示すといった現象を指す。このためには、自己にとっての異物(細菌・ウイルス・癌細胞など)を認識し、これをを攻撃・排除することが要求される。
 免疫小史
免疫小史・古代ギリシャの"Peloponnesus戦史"にも、免疫に関する現象の記載がある。
・古代中国やアラビアの人痘接種(variolation)の実施。危険の多いものだった。
・E. Jenner (1796年): 牛痘(cow pox; vaccinia)接種法→接種法(vaccination)。
・L. Pasteur (1881年): 炭疽病のワクチン。狂犬病の予防接種(1885年)⇒免疫の概念を提唱。ワクチン(vaccine)の用語。
・E. Metchnikoff (1884年): 免疫の細胞説。遊走性の食細胞が生体防御力の基礎
⇒細胞性免疫(cellular immune response) の概念
・E. von Behringと北里柴三郎 (1890年): 抗毒素説。ジフテリアや破傷風の抗毒素を発見
⇒液性免疫(humoral immune response)
・P. Ehrlich (1891年): 抗体(antikorper、英語ではantibody)の用語。
・Bordet (1895年): 補体(complement)を報告。補体と命名したのはEhrlich。
・凝集反応の発見(1896年)、沈降反応の発見(1897年)。
・P. Ehrlich(1900年): 抗体産生の機序として"側鎖説"を提唱。
・Landsteiner (1900年): ABO血液型を発見。
・MN型(1927年),P型(1927年),Rh型(1940年)の発見。
・Heidelberger (1937年): 超遠心法で2種の抗体の存在を確証。→7S (IgG)と19S (IgM)抗体分子。
・Kabat (1937年): 血清の電気泳動
・Mayerら (~1948年): 溶血(菌)反応における補体の古典的経路(classical pathway)を解明。
・Dausset (1952年): 白血球抗原の研究→ヒト組織適合抗原(HLA)の解明へ。
・Pillmer (1954年): プロパージンを発見→補体の副経路(alternative pathway)の存在を示唆。
・Edelman (1958年): 免疫グロブリンIgGの分子構造解明。
・石坂ら(1966年): 喘息,ジン麻疹,食餌性アレルギーの原因となる免疫グロブリンE (IgE)を発見。
凝集反応と沈降反応
沈殿の量は,抗原と抗体の量比が最適の場合に最大となる。
側鎖説
細胞内で過剰生産され,細胞外へ放出され,これが抗体となる。
赤血球の血液型抗原
|
|
|
| 抗原と抗体 |   |
|
|
|
ハプテンと抗原決定基の概念
 抗原(antigen): 抗体を作らせることのできる物質の総称。
抗原(antigen): 抗体を作らせることのできる物質の総称。 抗体(antibody): 抗原と特異的に結合するタンパク質⇒免疫グロブリン(immunoglobulin)という
抗体(antibody): 抗原と特異的に結合するタンパク質⇒免疫グロブリン(immunoglobulin)という 抗原決定基(determinant): 抗体によって認識される抗原分子の特定の部位
抗原決定基(determinant): 抗体によって認識される抗原分子の特定の部位
ヒト血清の電気泳動 抗体は グロブリン分画に存在
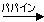 2 Fab + Fc
2 Fab + Fc5つのクラスの免疫グロブリンの性質
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
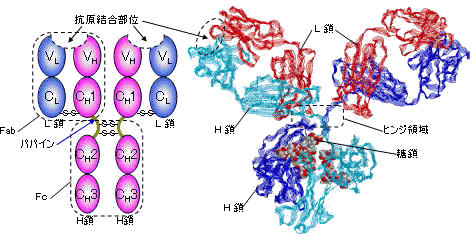
| 免疫グロブリンG (IgG)のドメイン構造(左)と立体構造(右) |
|
|
|
| 補体 |   |
|
|
|
 補体の成分とはたらき 補体の成分とはたらき |
溶血(菌)反応における補体の作用機序はMayerら (~1948年)によって解明された。⇒古典的経路=C1~C9の一連の反応による。
補体成分の種類と諸性質
一方、酵母の細胞壁多糖類と反応する易熱性の血清タンパク質プロペルジン(B因子)の存在が示され、C1、C4、C2とは無関係に、C3の活性化からはじまる補体活性化反応が知られるようになった。この経路を補体の副経路(alternative pathway)という。⇒非特異的生体防御系(補体系の起源としてはこちらが先)。さらに,細菌細胞壁のマンノース糖鎖にMBL(マンノース結合レクチン)が結合し,それにMASP(MBL associated serine protease)-1と-2が結合してC1様の複合体を形成し,これがC4の分解を引き起こし,後は古典的経路と同じ反応経路をたどるレクチン経路が知られている。3つの経路はC3で合流する。
補体第1成分C1qrsの構造とIgGとの結合
古典的経路による細胞膜の損傷 補体第5~9成分による細胞侵襲複合体(MAC)の形成と細胞の破壊
補体系の機能と生物活性物質 古典的経路と副経路はC3で合流
 補体の3つの働き(まとめ) 補体の3つの働き(まとめ) |
①細胞溶解: 古典的経路が関与。
②免疫細胞の活性化
Bb: マクロファージを活性化
C3a, C5a: 好中球の走化(chemotaxis作用,炎症部位へ食細胞を
呼び寄せる)。肥満細胞を活性化(anaphylatoxin作用)。
③免疫粘着反応とオプソニン効果
C3b: 菌体表面に結合(C3bコーティング)
→オプソニン効果で貪食を助ける。
C3b: 抗原抗体複合体を赤血球や血小板に付着させる(免疫粘着)。
C3は分子量19万で、2本鎖からなる糖蛋白。補体成分の中では最も高濃度に存在。肝臓、単球、マクロファージで産生。補体成分C3bによるオプソニン効果
C3b受容体(補体受容体,CR1)をもつ食細胞が菌体に結合し,貪食。
貪食作用を受けやすくする効果をオプソニン効果という。
 補体系の制御 補体系の制御 |
補体系は異物細胞のみを破壊し、同種細胞を決して破壊しない→同種補体を制御する制御因子が血漿中や同種細胞膜に存在するため。
①可溶性制御因子
C1インヒビター(C1INH),I因子,H因子,C4結合蛋白質(C4bBP),
S protein (Vitronectin)など
②膜補体制御因子
CR1(補体受容体1/ CD35),DAF(decay accelerating factor/CD55),
MCP(membrane cofactor protein/CD46),CD59 [GPIアンカー]
補体制御蛋白質
a) Decay accelerating factor. b)Membrane cofactor protein. c) Homologous restriction factor
タンパク質 存在 機能 C1 INH 血漿 活性型C1の解離,C1s, C1rの阻害 C4結合蛋白質 (C4BP) 血漿 C3転換酵素の解離,I因子のcofactor Properdin 血漿 C3bBbやC3bBb3bの安定化(膜上) H因子 血漿 副経路C3転換酵素の解離,I因子のcofactor I因子 血漿 C4bとC3b分解(セリンプロテアーゼ) serum proteases 血漿 anaphylatoxinsの不活性化 S protein (vitronectin) 血漿 可溶性C567の膜への結合阻害 補体受容体1(CR1) 細胞膜 C3転換酵素の解離,I因子のcofactor DAFa) (CD55) 細胞膜 C3 and C5転換酵素の解離,I因子のcofactor MCPb) (CD46) 細胞膜 I因子のcofactor HRFc) (C8BP, MIP) 細胞膜 MAC形成を阻害 protectin (CD59) 細胞膜 C8に結合しMAC形成を阻害
CD59のはたらき
|
|
|
| 免疫系の細胞と働き |   |
|
|
|
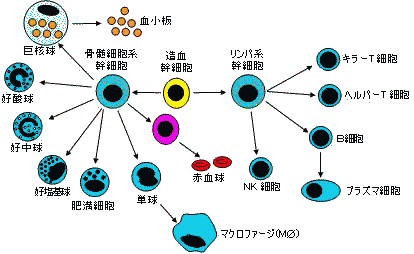
 免疫細胞の種類と役割 免疫細胞の種類と役割 |
主要リンパ器官
1次リンパ器官 2次リンパ器官 骨髄
胸腺全細胞の源
顆粒球,赤血球の分化
T細胞の分化腋リンパ節,股間リンパ節
Waldeyer環(リンパ節,扁桃,アデノイド)
脾臓,パイエル板,腸間膜リンパ節
ヒトの細胞: 60兆個
免疫細胞が2兆個,脳細胞が1000億個,
肝臓の細胞が2500億個
 |
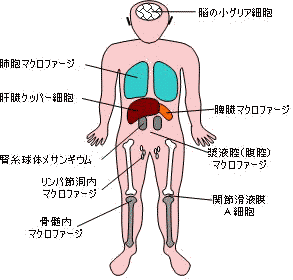 |
| 免疫系細胞および赤血球の分化 | 細網内皮系の食細胞 |
 |
|
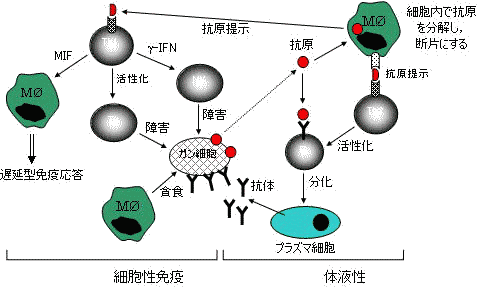
| 宿主免疫監視機構 | |
図の左側は細胞間相互作用で異物を排除する機構。 |
 免疫細胞間の相互作用 免疫細胞間の相互作用 |
細胞接着分子が関与
|
 |
||
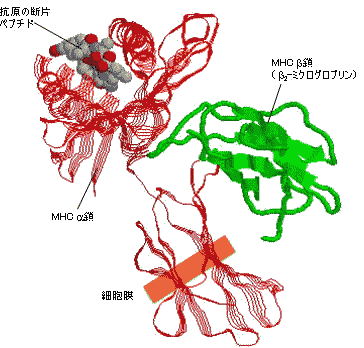
| 抗原の断片ペプチドと結合したヒトクラスI MHC(HLA-A)の立体構造 | |||
抗原ペプチドはMHC 鎖のへリックスでできた溝に結合している。 |
 主要組織適合遺伝子複合体(MHC) 主要組織適合遺伝子複合体(MHC) |
ヒトHLAの遺伝子領域(左)と産物(右)
(右)クラスIは共通の 鎖として b2-ミクログロブリンをもつ。
*MHC対立遺伝子産物
1993年の時点で,HLA-Aが24,HLA-Bが51,HLA-Cが11,HLA-DRが20,HLA-DQが9,HLA-DPが6種認定されている。それぞれのヒトは,これらの遺伝子座の対立遺伝子の特定の組み合わせをもつが,その組み合わせの数は天文学的数字になる。
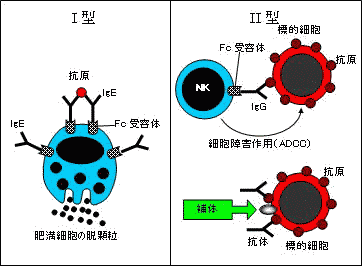
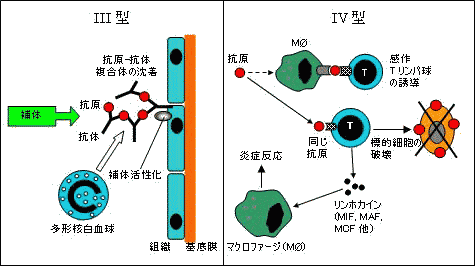
 免疫反応による組織障害 免疫反応による組織障害 |
|
|
|
| 抗体産生の理論 |   |
|
|
|
 クローン選択説 クローン選択説 |
|
Burnet (1957年)は、クローン選択説を提唱。「胎生期に免疫担当細胞が対応する抗原(自己物質)に結合すると,その細胞は死滅する(アポトーシス)」。免疫寛容や自己不応答性をうまく説明できる。
鋳型説
反論→理論的に無数にある抗原や,動物が進化の過程で出会ったことのない人工抗原に対して抗体遺伝子を準備しているとは考えにくい。
クローン選択説
 免疫グロブリンのドメイン構造 免疫グロブリンのドメイン構造 |
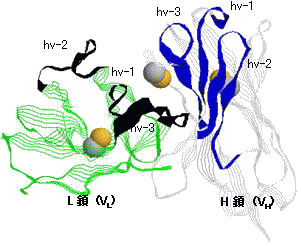 免疫グロブリン可変部の立体構造
 抗体の多様性の謎 抗体の多様性の謎
|
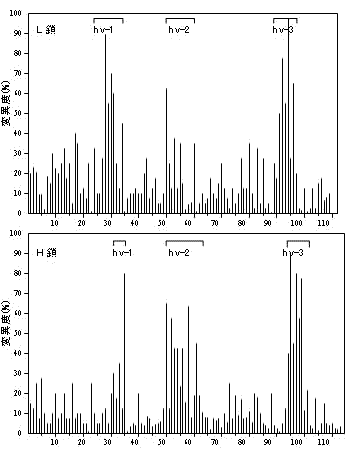 免疫グロブリンL鎖とH鎖超可変部のアミノ酸置換率 |
 |
|
||||||||
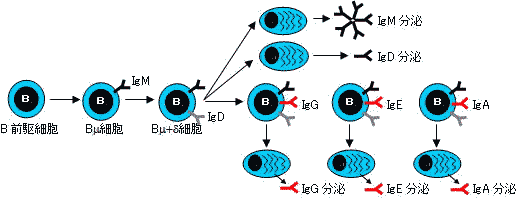
| B細胞の分化とクラススイッチ | |||||||||
B細胞は分化とともに細胞膜表面の免疫グロブリン型抗原受容体を変化させる。 |
これら可変域遺伝子の組み合わせだけでも,多数の抗体をつくれる。さらに,V-DやD-J領域のつなぎ方のずれが生じ,つなぎ目の残基に変異が起きる。VDJ領域は第3超可変域(hv-3)に相当。ヒトの場合,つなぎ目のずれによる変異数5とすると,上の表から,300×4×5×400×12×4×5×5 = 28.8億もの抗体を準備できることになる。
免疫グロブリンH鎖遺伝子の再編成(rearrangement)
生殖細胞の可変域遺伝子数 Family V gene segments V D J マウス Vλ 2 0 3 Vκ 約250 0 4 VH 約500 12 4 ヒト VL 約300 0 4 VH 約400 約12 約4
【Somatic mutationによる抗体の多様性の拡大】
L鎖,H鎖可変部の超可変部(hv1~3)と遺伝子の関係
H鎖の第3超可変部(hv-3)におけるV/D/J組換えとタンパク質のアミノ酸配列
V とJ (L 鎖遺伝子)の遺伝子組換え信号配列
V/J組み換えによるアミノ酸の変異 体細胞突然変異モデル ●は導入された変異。
 T細胞受容体(TCR) T細胞受容体(TCR) |
T細胞レセプターの摸式図 マウスT細胞レセプターの遺伝子構造
|
|
|
| 免疫化学的手法 |  |
|
|
|
 抗体を用いる物質の検出法
抗体を用いる物質の検出法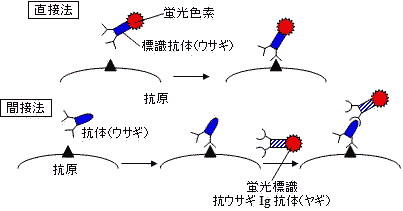 |
| 蛍光抗体法の原理 |
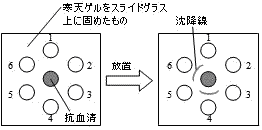 |
| Ouchterlony法による抗原の検出 |
①中央の穴に抗体(抗血清),1~6に試料(抗原)を入れる。 |
 抗体を用いる物質の定量法 抗体を用いる物質の定量法 |
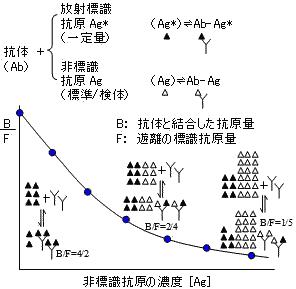 |
| 放射免疫定量法(RIA)の原理 |
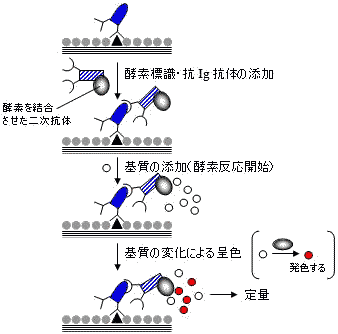 |
| 間接ELISAによる定量法 |
 新しい免疫学の技術 新しい免疫学の技術 |
・単クローン性抗体(monoclonal antibody) タンパク質として純粋な抗体
・抗体酵素(catalytic antibody, abzyme)
有機化学反応の遷移状態中間体に類似した,安定な化合物を抗原として得られる単クローン性抗体。⇒同一または類似の反応を触媒する。基質特異性や光学選択性を示す。
(例)4-nitrophenylphosphonateに対する抗体
同基質の加水分解反応を触媒。Km=0.66 mM, kcat=1.4 min-1
抗体酵素

|